生命學院李雪明課題組在細菌curli菌毛生成系統的結構研究中取得進展
2020/02/055022
2020年1月13日,清華大學生命科學學院李雪明研究組在《自然通訊》(Nature Communications)雜志在線發表題為“curli菌毛生成系統的組裝和底物識別”(Assembly and substrate recognition of curli biogenesis system)的研究論文。該論文報道了細菌curli菌毛生成系統(也稱細菌八型分泌系統)膜上通道復合物的近原子分辨率結構,結合結構生物學手段和生化研究揭示了其新的組裝機制和底物識別機制。同時,該研究開發了一個新的多肽抑制劑,為之后curli生成系統抑制劑的研發提供了新思路。
為了在宿主體內或者環境中更好的定植和生存,許多細菌選擇聚集在一起形成由蛋白,核酸以及多糖形成的親水基質包裹的封閉群落。這些由大量親水大分子包裹的基質叫作生物被膜。細菌的生物被膜在很多感染性疾病中充當重要的致病因素,例如屏蔽型靜脈導管,人工瓣膜感染性心內膜炎,以及Foley導管相關性尿路感染。curli菌毛作為生物被膜的重要組成部分,研究curli菌毛生成系統的組裝和分泌機制對發展生物被膜相關疾病的治療方法和治療藥物至關重要。curli生成系統由7個curli特異性相關基因(CsgA,CsgB,CsgC,CsgD,CsgE,CsgF和CsgG)組成,CsgA和CsgB是八型分泌系統的底物,CsgE,CsgF以及CsgG是分泌通道復合物的組成成分,負責特異性識別和分泌天然底物CsgA和CsgB。目前,對于通道復合物是如何組裝以及底物CsgA是如何被通道復合物識別并分泌的機制并不清楚。
李雪明課題組通過冷凍電鏡單顆粒重構的方法解析了大腸桿菌來源的curli生成系統膜上通道復合物CsgFG以及結合了底物的通道符合物CsgFG-CsgAN22的高分辨率結構,分辨率分別達到3.38 A 和3.34 A。CsgFG復合物的結構顯示CsgF與CsgG形成9:9結合的雙孔道復合物,CsgF的N端(CsgFN)插入到CsgG的b桶內部與CsgG相互作用。體外蛋白結合實驗驗證CsgFN與CsgG相互作用,CsgF的C端(CsgFC)與CsgB相互作用。進一步的體外蛋白結合實驗顯示CsgB結合CsgA,CsgF不結合CsgA。綜合電鏡結構和體外蛋白結合實驗結果,我們提出了CsgG-CsgFN-CsgFC-CsgB-CsgA的組裝方式,闡明了curli纖維如何結合到細菌表面的機制。此外,通過將CsgF的孔道氨基酸Asn17突變成不同側鏈性質的氨基酸,我們發現疏水和帶電氨基酸不利于親水底物的轉運,而親水不帶電的氨基酸更有利于底物轉運。當把Asn17突變成長鏈的Arg,縮小了孔道的大小,同樣也會影響底物的分泌。基于該實驗結果,我們設計了一個多肽抑制劑PeptideNN17R,剛果紅實驗結果顯示該抑制劑具有較強的抑制作用。
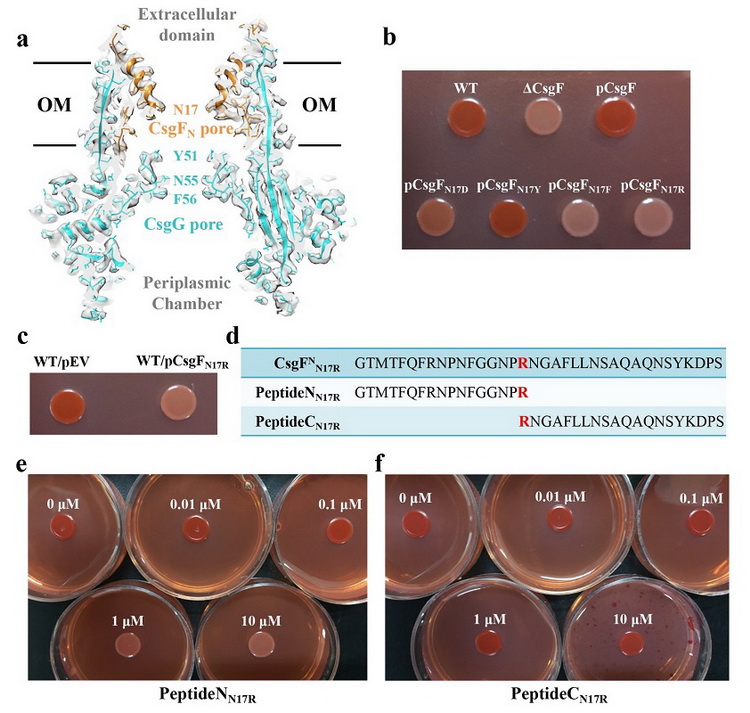
CsgFG的雙孔道結構和多肽抑制劑
我們解析的CsgFG-CsgAN22的結構中顯示CsgA的N末端6個氨基酸能與CsgG通道的外表面結合。多序列比對和單突變的剛果紅實驗結果顯示保守的Val3和Gln5對結合CsgG和分泌底物CsgA至關重要。體外蛋白結合實驗結果進一步發現CsgE能結合CsgA的R1-5結構域。CsgE的敲除菌株失去剛果紅的表型,而過表達CsgG蛋白后剛果紅表型得到恢復,這說明CsgE對底物分泌不是必須的,而是能提到轉運效率,綜合以上實驗結果,我們提出了CsgA的識別轉運模型。
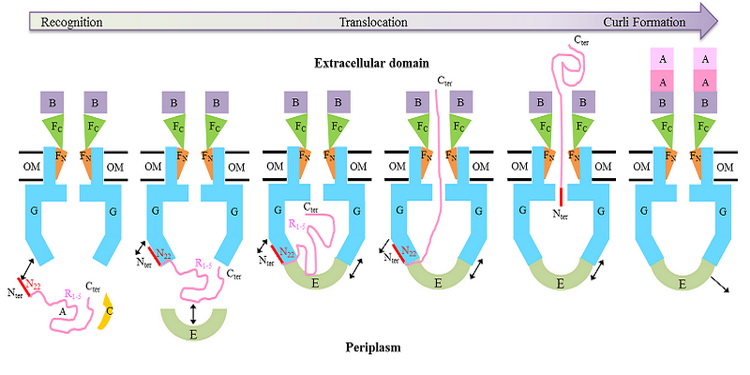
CsgA的識別轉運模型
清華大學生命科學學院李雪明副教授為本文的通訊作者。清華大學生命學院2019屆博士畢業生嚴照峰,清華大學PTN項目2019屆博士畢業生尹孟和清華大學生命學院2018級博士生陳佳楠為本文的共同第一作者。該工作的冷凍電鏡數據采集在國家蛋白質科學設施(北京)的清華大學冷凍電鏡平臺完成,數據處理在國家蛋白質科學設施(北京)清華大學生物計算平臺完成。該工作獲得了生命科學聯合中心,北京市結構生物學高精尖創新中心,國家自然科學基金委面上項目和科技部重點研發計劃的經費支持。
為了在宿主體內或者環境中更好的定植和生存,許多細菌選擇聚集在一起形成由蛋白,核酸以及多糖形成的親水基質包裹的封閉群落。這些由大量親水大分子包裹的基質叫作生物被膜。細菌的生物被膜在很多感染性疾病中充當重要的致病因素,例如屏蔽型靜脈導管,人工瓣膜感染性心內膜炎,以及Foley導管相關性尿路感染。curli菌毛作為生物被膜的重要組成部分,研究curli菌毛生成系統的組裝和分泌機制對發展生物被膜相關疾病的治療方法和治療藥物至關重要。curli生成系統由7個curli特異性相關基因(CsgA,CsgB,CsgC,CsgD,CsgE,CsgF和CsgG)組成,CsgA和CsgB是八型分泌系統的底物,CsgE,CsgF以及CsgG是分泌通道復合物的組成成分,負責特異性識別和分泌天然底物CsgA和CsgB。目前,對于通道復合物是如何組裝以及底物CsgA是如何被通道復合物識別并分泌的機制并不清楚。
李雪明課題組通過冷凍電鏡單顆粒重構的方法解析了大腸桿菌來源的curli生成系統膜上通道復合物CsgFG以及結合了底物的通道符合物CsgFG-CsgAN22的高分辨率結構,分辨率分別達到3.38 A 和3.34 A。CsgFG復合物的結構顯示CsgF與CsgG形成9:9結合的雙孔道復合物,CsgF的N端(CsgFN)插入到CsgG的b桶內部與CsgG相互作用。體外蛋白結合實驗驗證CsgFN與CsgG相互作用,CsgF的C端(CsgFC)與CsgB相互作用。進一步的體外蛋白結合實驗顯示CsgB結合CsgA,CsgF不結合CsgA。綜合電鏡結構和體外蛋白結合實驗結果,我們提出了CsgG-CsgFN-CsgFC-CsgB-CsgA的組裝方式,闡明了curli纖維如何結合到細菌表面的機制。此外,通過將CsgF的孔道氨基酸Asn17突變成不同側鏈性質的氨基酸,我們發現疏水和帶電氨基酸不利于親水底物的轉運,而親水不帶電的氨基酸更有利于底物轉運。當把Asn17突變成長鏈的Arg,縮小了孔道的大小,同樣也會影響底物的分泌。基于該實驗結果,我們設計了一個多肽抑制劑PeptideNN17R,剛果紅實驗結果顯示該抑制劑具有較強的抑制作用。

CsgFG的雙孔道結構和多肽抑制劑
我們解析的CsgFG-CsgAN22的結構中顯示CsgA的N末端6個氨基酸能與CsgG通道的外表面結合。多序列比對和單突變的剛果紅實驗結果顯示保守的Val3和Gln5對結合CsgG和分泌底物CsgA至關重要。體外蛋白結合實驗結果進一步發現CsgE能結合CsgA的R1-5結構域。CsgE的敲除菌株失去剛果紅的表型,而過表達CsgG蛋白后剛果紅表型得到恢復,這說明CsgE對底物分泌不是必須的,而是能提到轉運效率,綜合以上實驗結果,我們提出了CsgA的識別轉運模型。

CsgA的識別轉運模型
清華大學生命科學學院李雪明副教授為本文的通訊作者。清華大學生命學院2019屆博士畢業生嚴照峰,清華大學PTN項目2019屆博士畢業生尹孟和清華大學生命學院2018級博士生陳佳楠為本文的共同第一作者。該工作的冷凍電鏡數據采集在國家蛋白質科學設施(北京)的清華大學冷凍電鏡平臺完成,數據處理在國家蛋白質科學設施(北京)清華大學生物計算平臺完成。該工作獲得了生命科學聯合中心,北京市結構生物學高精尖創新中心,國家自然科學基金委面上項目和科技部重點研發計劃的經費支持。
論文鏈接:https://www.nature.com/articles/s41467-019-14145-7
原文鏈接:http://life.tsinghua.edu.cn/publish/smkx/11191/2020/20200114153508736418517/2020011415350873
原文鏈接:http://life.tsinghua.edu.cn/publish/smkx/11191/2020/20200114153508736418517/2020011415350873
返回列表