作者:曹慧珍
“相分離”物理化學領域中的基本概念,這一現象可追溯至鴻蒙初始,盤古開天辟地,清者上升為天,濁者下沉為地。“相分離”也是生物學研究領域的熱詞,CNS2018年已發表多篇相關報道。細胞中的相分離,細胞內特定分子聚集起來形成液滴形成特定環境加速生物學反應,具有重要的生物學意義。小編不是科研工作者,就不班門弄斧給大家科普“相分離”的重要意義了,大家可以去查閱相關文獻。小編是顯微鏡工作人員哦,可以給大家提供相分離結構研究過程中顯微鏡圖像采集的技術支持!
1. 相分離的基礎----確定蛋白質形成液滴的濃度以及液滴的尺寸
這也是顯微鏡成像中的基礎篇哦,設置好成像光路(根據蛋白的熒光標記+TD),采集不同濃度樣品的熒光和透射光成像即可。
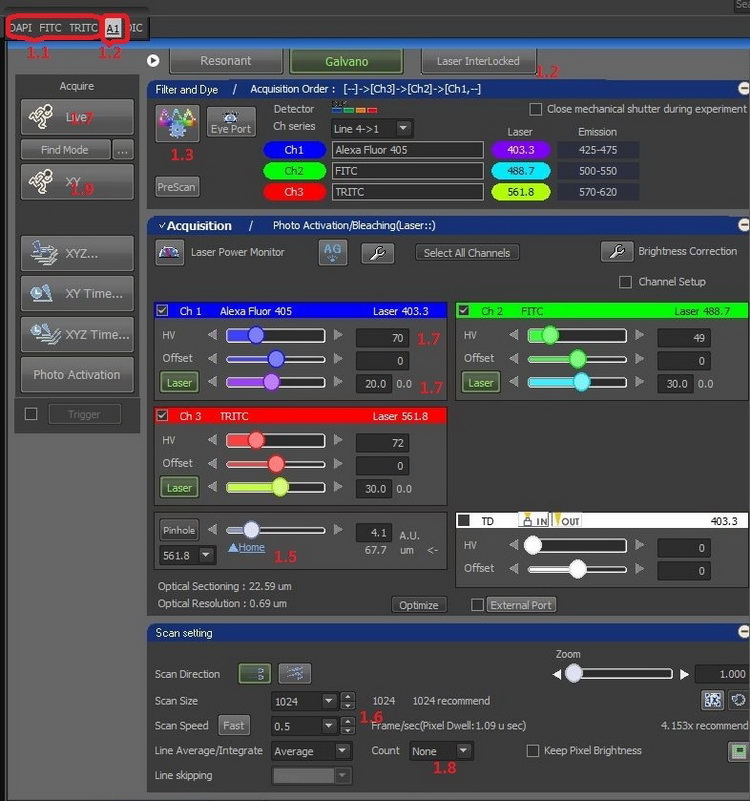
1.1選擇物鏡(根據物鏡型號確定是否加油加水),點擊OC在顯微鏡目鏡下確認樣品位置和焦面。
*相變的尺寸是微米級的,所以通常情況下直接選擇60X或100X油鏡;但對于初學者或者底部厚度>0.17mm的器皿,選擇20X物鏡,通過zoom后續放大。
1.2點擊A1切換至共聚焦顯微鏡成像,點擊[Laser Inter Locked]按鈕,解除閃爍狀態,使激光可以通過軟件解除鎖定。
1.3點擊打開光路設置窗口
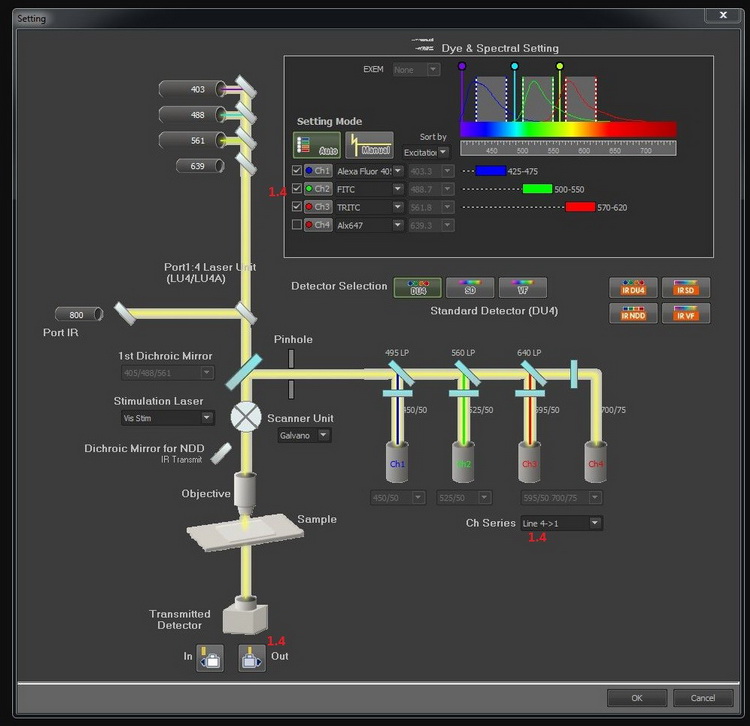
1.4勾選需要的通道(根據蛋白標記的熒光信號),如果觀察多種蛋白相分離,根據不同蛋白標記勾選多個通道,點擊 按鈕,透射光檢測器進入光路,同時獲取透射圖像。
按鈕,透射光檢測器進入光路,同時獲取透射圖像。
*多通道圖像采集時,需注意通道順序Ch Series,為避免串色,建議選擇line4?1順序采集模式,如多色熒光相互之間確定不會串色,可選擇none模式,提高采集速度。
1.5在Pinhole的項目中點擊[▲Home]按鈕,選擇與物鏡最匹配的針孔尺寸。
1.6調整像素數為所需要的分辨率(512×512或1024×1024等),選擇掃描速度(信號較弱時,可降低掃描速度,提高信號亮度)。
1.7點擊[Live]按鈕,先調節至最佳焦面,然后邊觀察圖像邊調節激光功率和檢測器的靈敏度HV。
*提高Laser和HV都可提升圖片亮度,但HV過高,噪音增加,信噪比會降低,Laser過高,會帶給樣品光毒性,不利于多次圖像采集,請根據實驗目的,合理調整Laser和HV獲得最佳成像效果。
1.8根據需要選擇Average,提升信噪比。
1.9點擊[XY]按鈕以獲取圖像。
1.10菜單欄中選擇[File] -> [Save As]保存圖像。
2. 液滴融合或分離實驗
timelapse時間序列圖像采集
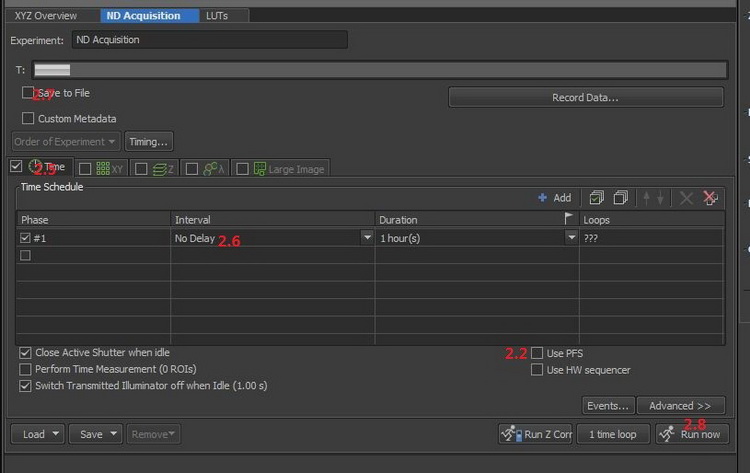
2.1重復1.1-1.6
2.2打開PFS完美聚焦系統,較正熱漂移帶來的焦面變化,保證長時間拍攝焦面穩定性。
2.3點擊[Live]按鈕,先調節至最佳焦面,然后邊觀察圖像邊調節激光功率和檢測器的靈敏度HV。
2.4根據需要選擇Average,提升信噪比。
2.5進入ND Acquisition窗口,勾選T
2.6設置時間間隔(Interval)和持續時間(Duration),Interval需大于單張圖像采集時間。
2.7勾選[Save to File],在采集圖像的同時保存圖像。
2.8點擊[Run now]按鈕,獲取時間序列圖像。
*若液滴運動速度較快,可將Interval設置為no delay,并可通過降低圖像分辨率和不選擇Average保證采集速度盡量大。
*若液滴容易淬滅,保證亮度信噪比的同時盡量降低激光強度,對于運動較慢的液滴可以設置較長的Interval間隔來降低采圖對于熒光染料的淬滅。
Nott, T. J. et al.
3. 細胞或離體環境中液滴的分布
三維序列圖像采集
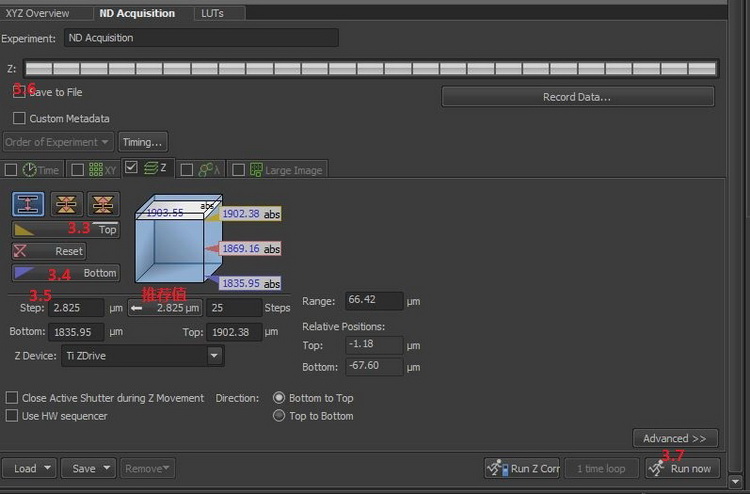
3.1重復1.1-1.8
3.2進入ND Acquisition窗口,勾選Z
3.3點擊[Live]按鈕,邊預覽邊調節焦面至信號消失,點擊[Top]按鈕,確定三維圖像的頂面
3.4繼續預覽,反方向調節焦面,信號增強再減弱至消失,點擊[Bottom]按鈕,確定三維圖像底面,停止預覽。
3.5輸入Step,建議選擇推薦值的1-2倍。
3.6勾選[Save to File],在采集圖像的同時保存圖像。
3.7點擊[Run now]按鈕,獲取三維序列圖像。
3.8點擊 [Show Volume View]按鈕,構筑三維圖像。用鼠標拖動三維圖像的邊框,以調節到所需的角度。從菜單欄中執行[Edit] -> [Create View Snapshot (8bit RGB)],獲取特定角度的圖像。
[Show Volume View]按鈕,構筑三維圖像。用鼠標拖動三維圖像的邊框,以調節到所需的角度。從菜單欄中執行[Edit] -> [Create View Snapshot (8bit RGB)],獲取特定角度的圖像。
3.9點擊[Show Movie Maker]按鈕,開始創建旋轉圖像,旋轉拖拉右側各種旋轉模塊進入時間軸,然后點擊[Create Movie]按鈕創建影像。從菜單欄中選擇[File] -> [Save As]將創建的動畫保存為avi。
4. 通過FRAP實驗研究相分離結構與周圍環境的物質交換
4.1重復1.1-1.6
4.2打開PFS完美聚焦系統,較正熱漂移帶來的焦面變化,保證長時間拍攝焦面穩定性。
4.3點擊[Live]按鈕,先調節至最佳焦面,然后邊觀察圖像邊調節激光功率和檢測器的靈敏度HV。
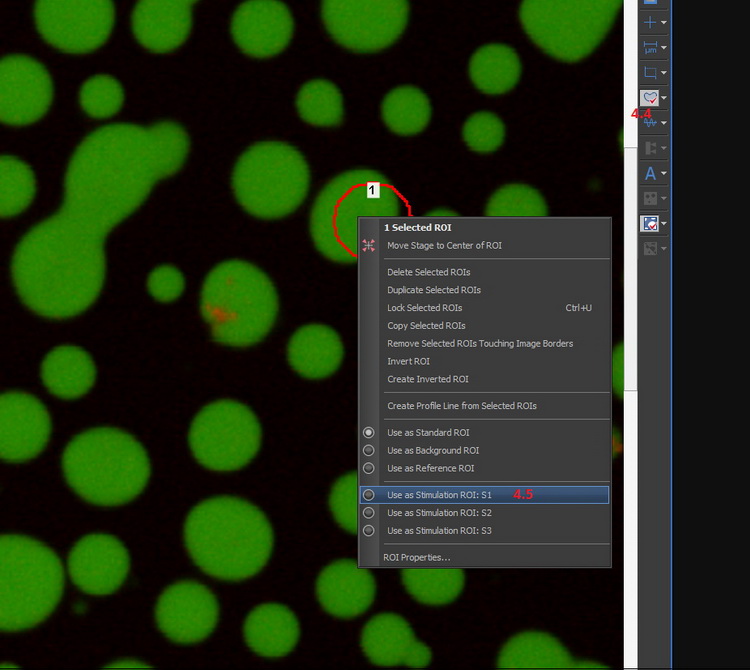
4.4點擊圖像側面邊框上 的按鈕,在圖像上繪制ROI。
的按鈕,在圖像上繪制ROI。
4.5在ROI上鼠標右擊,從彈出的菜單中選擇[Use as Stimulation ROI]。
4.6點擊Photo Activation,切換設定畫面。選擇刺激用的激光及激光功率,選擇刺激的掃描速度。
4.7點擊 [Photo Activation]按鈕,啟動ND Stimulation窗口。
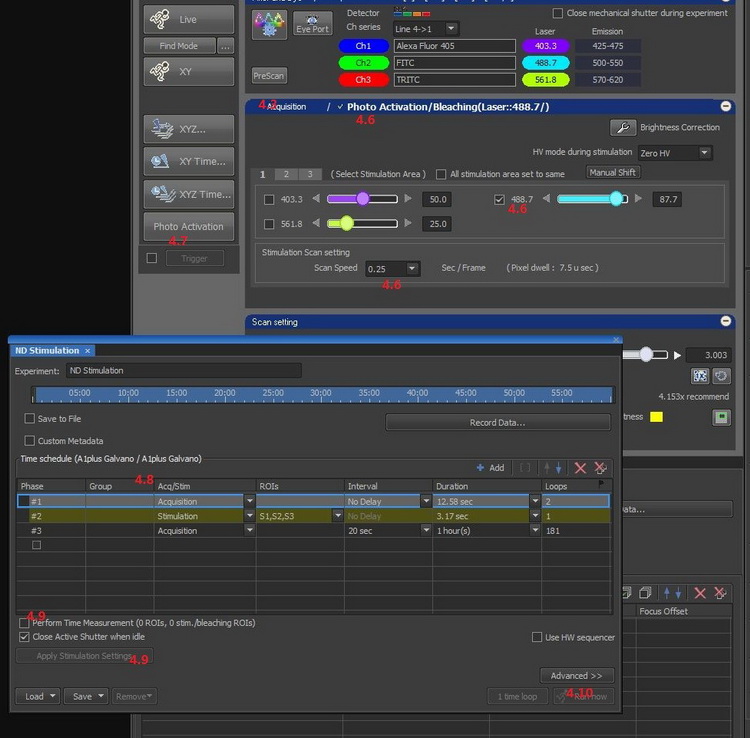
4.8在ND Stimulation窗口設置FRAP程序,通常我們先添加一條采集程序,采集2-3張漂白前的圖像(no delay),然后增加一條刺激程序,該程序的ROI編號需于4.5中一致,最后我們添加一或多條采集程序(采集漂白后恢復圖像),Interval和Duration取決于液滴熒光的恢復速度及抗淬滅能力。
4.9點擊[Apply Stimulation Settings]按鈕,讀取光刺激成像的設定。可勾選[Perform Time Measurement]在獲取圖像的同時獲取ROI內熒光信號的時間序列變化圖。
4.10點擊 [Run now]按鈕,執行光刺激成像,獲取FRAP圖像。
*FRAP實驗不是一蹴而就的,整個ND stimulation包含三條及以上程序,#1是約定俗成的采集2-3張圖像,記錄漂白前的圖像,#2和#3都是需要不斷嘗試的。
#2決定了樣品能否被漂白,漂白到什么程度,#3反映了漂白區域的熒光信號恢復速度。在沒有相關實驗參考的前提下FRAP圖像采集建議:
a) 按照以下程序run:刺激用激光功率先設定為100%,刺激速度1s/f,#1 acquisition no delay 2 loops,#2 stimulation S1 no delay 1 loops,#3 acquisition no delay 2 loops。
b) 根據上述結果圖像,判斷ROI區域是否被漂白,漂白效率是多少,漂白區域是否與ROI區域匹配。若未被漂白或漂白效率不足50%,需提高漂白時間,通過提高Scan speed或#2中loops都可;若漂白效率高于95%或漂白區域大于ROI區域時,需降低刺激時間或刺激光的強度,因#2中loops為1僅可通過降低Scan speed降低漂白時間;多次測試后獲取最佳漂白參數。
c) 修改#3, acquisition no delay duration5min,采集一組圖像,判斷樣品信號的恢復速度以及抗淬滅能力。若樣品恢復速度非常快,10s內需要調整Scan setting,犧牲一部分圖像分辨率以最快的速度采集圖像;若樣品恢復速度較慢,可設置interval,減少光毒性和數據量;若信號的恢復速度慢且易淬滅,首先需要調整Acquisition參數,降低Laser提高HV,然后必須提高Interval間隔時間。
d) 如想一次性漂白多個區域,建議ROI分別Use as Stimulation ROI 1、2、3而非都Use as Stimulation ROI 1,如果使用后者無法使用一個ROI摸索出的漂白參數,漂白效果未知,還需注意在Photo Activation窗口下勾選all stimulation area set to same,#2中ROIs選擇S1,S2,S3。
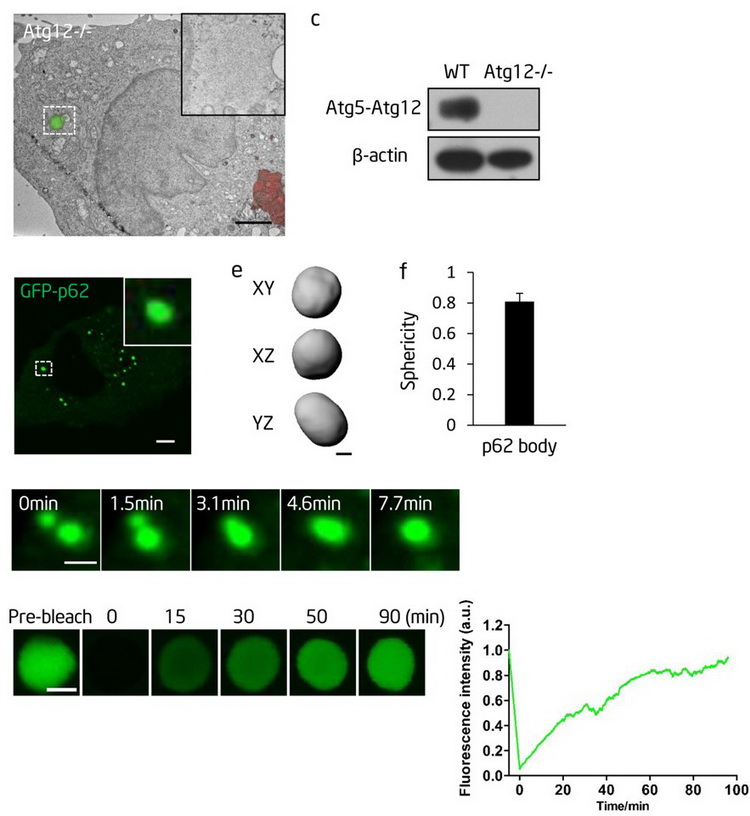
Sun D, Wu R, Zheng J, Li P, Yu L. Cell research 2018;28:405-15.采集自本平臺
本文章版權歸清華大學生物醫學測試中心尼康影像中心所有